
sexta-feira, 28 de março de 2008
ATOMÍSTICA - Estudo do átomo

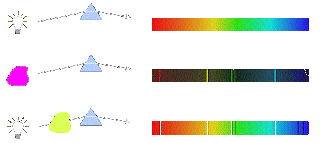
Quando átomos são aquecidos ou submetidos a uma descarga elétrica, eles absorvem energia, que em seguida é emitida como radiação. Por exemplo, se o cloreto de sódio é aquecido na chama de Bunsen, serão produzidos átomos de sódio, que dão origem a uma coloração amarela característica na chama, produzindo linhas espectrais descontínuas em aparelhos específicos. Essa luz emitida pelos átomos podem ser estudadas em espectrômetros, verificando-se que elas são constituídas por linhas com diferentes comprimentos de onda.
*Em 1913 ,Bohr afirmou que os fenômenos atômicos não poderiam ser explicados pelas Leis da Física Clássica.
Niels Bohr, dinamarquês, contribuiu para o aperfeiçoamento do modelo atômico de Rutherford. Baseado na teoria quântica, Bohr explicou o comportamento dos elétrons nos átomos. Para Bohr, os elétrons giram em torno do núcleo de forma circular e com diferentes níveis de energia. Seus postulados:
- O átomo possui um núcleo positivo que está rodeado por cargas negativas;
- A eletrosfera está dividida em camadas ou níveis eletrônicos, e os elétrons nessas camadas, apresentam energia constante;
- Em sua camada de origem (camada estacionária) a energia é constante, mas o elétron pode saltar para uma camada mais externa, sendo que, para tal é necessário que ele ganhe energia externa;
- Um elétron que saltou para uma camada de maior energia fica instável e tende a voltar a sua camada de origem; nesta volta ele devolve a mesma quantidade de energia que havia ganho para o salto e emite um fóton de luz.
ATOMÍSTICA

ATOMÍSTICA

sábado, 1 de março de 2008
OS ALQUIMISTAS
Se alguém perguntar a você de que as coisas são feitas,responda: Tudo que existe no mundo, é feito de matéria. Essa é a resposta da ciência. Tudo no mundo é matéria, arranjada nas maneiras mais diferentes. Até mesmo os nossos corpos são feitos de matéria, pele, osso, sangue,... Absolutamente tudo, é composto por pedacinhos minúsculos,impossíveis de serem vistos a olho nu.
A busca pela compreensão dos mistérios da matéria, começou a intrigar os homens na Grécia antiga. Um filosofo grego chamado Aristóteles, acreditava que tudo que havia na terra, era feito de quatro elementos: ÁGUA, FOGO,TERRA E AR. Para ele, a terra era responsável dar forma às substâncias às coisas. O fogo ,era fonte de calor e energia. O ar, representava o espaço vazio, movimentos, cheiros e sons. A água era o solvente que trazia a umidade e o equilíbrio com a mistura dos elementos. Segundo Aristóteles, a quantidade de cada um desses 4 elementos em combinação, é o que dava à matéria, suas mais diferentes aparências.
Essa idéia dos 4 elementos, foi aceita durante muitos e muitos anos. Séculos depois do grego, homens que viveram na Europa e no Oriente durante a idade média, tentaram ir além, entender melhor os mistérios da matéria. Esses homens eram os alquimistas.
Os alquimistas acreditavam que usando os poderes do fogo, seriam capazes de purificar metais e transformá-los nos mais nobres de todos: O OURO. Alquimistas de todos os lugares, passaram suas vidas atrás de uma substância mágica, capaz de transformar metais em ouro, a tão sonhada pedra filosofal. A busca era na base de tentativas e erros e exigia muita paciência. Os alquimistas acreditavam que a prática purificava não só a matéria, mas também o espírito. Além da pedra filosofal, procuravam também por uma porção mágica, o elixir da longa vida. Aquele que alcançasse os dois objetivos, ficaria rico e viveria muitos e muitos anos, uma proposta tentadora.
Claro que uma fórmula capaz de transformar chumbo em ouro, era o chamariz perfeito para achar ladrões. Durante a idade média, foram muitos os alquimistas mal intencionados que ofereceram seus serviços a reis gananciosos, que sonhavam ver seus cofres cheios de ouro. Vários alquimistas foram desmascarados e acabaram os seus dias nos castelos(sofrendo).
Na época dos primeiros alquimistas, não havia separação entre matéria e espírito. Por isso, explorar as propriedades das matérias,era também explorar os mistérios do espírito.
quinta-feira, 15 de novembro de 2007
2007
Só quero lembrar das coisas boas que aconteceram esse ano :D
Conheci pessoas que nuuunca vou esquecer, que estarão sempre no coraçãao (L)
.. Dedico esse blog ao meu professor Eduardo Callado... Dedico também a ele tudo que aprendi sobre química, além das lições que ele dava na aula né fessÔ? Bom, só sei que professores assim a gente nunca esquece, e sei que quando tiver fazendo vestiba, lembrarei dele .. kkkkkkkkkkkkkkkkkk Mas é isso aê Callado, parabéns por esse ano tão maravilhoso e parabéns por ser essa pessoa tão especial na vida da gente :D sentiremos sua falta !
- LEMBRE-SE QUE VOCÊ É UM VENCEDOR - Te amamos! -> (8vão!)
Reações Químicas
• Natureza dos reagentes;
• Energia de ativação;
• Choques efetivos.
Evidências da ocorrência de uma reação:
• Formação de precipitado
• Mudança de cor
• Liberação de gás
Classifiação das reações:
Síntese ou adição : A+B --> AB
Decomposição ou análise : AB --> A+B
Simples troca ou deslocamento : AB+C --> CB+A / AB+D --> AD+B
Fila de reatividade dos metais:
1A/2A/Al/Zn/Fe......H/Au/Ag
Fila de reatividade dos não-metais:
F/O/N/Cl/Br/I/S/C/P/H
• Reação de oxirredução:
-> Nox: número de oxidação: número de ligações que um elemento pode fazer. (Reais e Teóricas)
->Oxidação: perda de elétrons: NOX AUMENTA : agente redutor
->Redução: ganhou de elétrons: NOX DIMINUI: agente oxidante
O nox de toda substância é igual a zero.
Ex.: Cl2, O2, O3, N2, Fe(s), Zn(s)...
