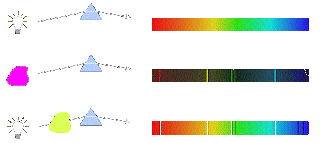
Quando átomos são aquecidos ou submetidos a uma descarga elétrica, eles absorvem energia, que em seguida é emitida como radiação. Por exemplo, se o cloreto de sódio é aquecido na chama de Bunsen, serão produzidos átomos de sódio, que dão origem a uma coloração amarela característica na chama, produzindo linhas espectrais descontínuas em aparelhos específicos. Essa luz emitida pelos átomos podem ser estudadas em espectrômetros, verificando-se que elas são constituídas por linhas com diferentes comprimentos de onda.
*Em 1913 ,Bohr afirmou que os fenômenos atômicos não poderiam ser explicados pelas Leis da Física Clássica.
Niels Bohr, dinamarquês, contribuiu para o aperfeiçoamento do modelo atômico de Rutherford. Baseado na teoria quântica, Bohr explicou o comportamento dos elétrons nos átomos. Para Bohr, os elétrons giram em torno do núcleo de forma circular e com diferentes níveis de energia. Seus postulados:
- O átomo possui um núcleo positivo que está rodeado por cargas negativas;
- A eletrosfera está dividida em camadas ou níveis eletrônicos, e os elétrons nessas camadas, apresentam energia constante;
- Em sua camada de origem (camada estacionária) a energia é constante, mas o elétron pode saltar para uma camada mais externa, sendo que, para tal é necessário que ele ganhe energia externa;
- Um elétron que saltou para uma camada de maior energia fica instável e tende a voltar a sua camada de origem; nesta volta ele devolve a mesma quantidade de energia que havia ganho para o salto e emite um fóton de luz.

Nenhum comentário:
Postar um comentário